SA. Внутренняя энергия
Содержание |
Внутренняя энергия тел
Согласно MKT все вещества состоят из частиц, которые находятся в непрерывном тепловом движении и взаимодействуют друг с другом. Поэтому, даже если тело неподвижно и имеет нулевую потенциальную энергию, оно обладает энергией (внутренней энергией), представляющей собой суммарную энергию движения и взаимодействия микрочастиц, составляющих тело. В состав внутренней энергии входят:
- кинетическая энергия поступательного, вращательного и колебательного движения молекул;
- потенциальная энергия взаимодействия атомов и молекул;
- внутриатомная и внутриядерная энергии.
В термодинамике рассматриваются процессы при температурах, при которых не возбуждается колебательное движение атомов в молекулах, т.е. при температурах, не превышающих 1000 К. В этих процессах изменяются только первые две составляющие внутренней энергии. Поэтому
под внутренней энергией в термодинамике понимают сумму кинетической энергии всех молекул и атомов тела и потенциальной энергии их взаимодействия.
Внутренняя энергия тела определяет его тепловое состояние и изменяется при переходе из одного состояния в другое. В данном состоянии тело обладает вполне определенной внутренней энергией, не зависящей от того, в результате какого процесса оно перешло в данное состояние. Поэтому внутреннюю энергию очень часто называют функцией состояния тела.
Рассчитать внутреннюю энергию можно только для идеального газа, т.к. молекулы не взаимодействуют между собой и потенциальная энергия их равна нулю:
где i — степень свободы. Для одноатомного газа (например, инертные газы) i = 3, для двухатомного — i = 5.
Из этих формул видно, что внутренняя энергия идеального газа зависит только от температуры и числа молекул и не зависит ни от объема, ни от давления. Поэтому изменение внутренней энергии идеального газа определяется только изменением его температуры и не зависит от характера процесса, в котором газ переходит из одного состояния в другое:
где ΔT = T2 - T1.
- Молекулы реальных газов взаимодействуют между собой и поэтому обладают потенциальной энергией Wp, которая зависит от расстояния между молекулами и, следовательно, от занимаемого газом объема. Таким образом, внутренняя энергия реального газа зависит от его температуры, объема и структуры молекул.
*Вывод формулы
Средняя кинетическая энергия молекулы \(~\left\langle W_k \right\rangle = \dfrac {i}{2} \cdot k \cdot T\).
Число молекул в газе \(~N = \dfrac {m}{M} \cdot N_A\).
Следовательно, внутренняя энергия идеального газа
Учитывая, что k⋅NA = R — универсальная газовая постоянная, имеем
Изменение внутренней энергии
Для решения практических вопросов существенную роль играет не сама внутренняя энергия, а ее изменение ΔU = U2 - U1. Изменение же внутренней энергии рассчитывают, исходя из законов сохранения энергии.
Внутренняя энергия тела может изменяться двумя способами:
- При совершении механической работы.
- а) Если внешняя сила вызывает деформацию тела, то при этом изменяются расстояния между частицами, из которых оно состоит, а следовательно, изменяется потенциальная энергия взаимодействия частиц. При неупругих деформациях, кроме того, изменяется температура тела, т.е. изменяется кинетическая энергия теплового движения частиц. Но при деформации тела совершается работа, которая и является мерой изменения внутренней энергии тела.
- б) Внутренняя энергия тела изменяется также при его неупругом соударении с другим телом. Как мы видели раньше, при неупругом соударении тел их кинетическая энергия уменьшается, она превращается во внутреннюю (например, если ударить несколько раз молотком по проволоке, лежащей на наковальне, — проволока нагреется). Мерой изменения кинетической энергии тела является, согласно теореме о кинетической энергии, работа действующих сил. Эта работа может служить и мерой изменения внутренней энергии.
- в) Изменение внутренней энергии тела происходит под действием силы трения, поскольку, как известно из опыта, трение всегда сопровождается изменением температуры трущихся тел. Работа силы трения может служить мерой изменения внутренней энергии.
- При помощи теплообмена. Например, если тело поместить в пламя горелки, его температура изменится, следовательно, изменится и его внутренняя энергия. Однако никакая работа здесь не совершалась, ибо не происходило видимого перемещения ни самого тела, ни его частей.
Изменение внутренней энергии системы без совершения работы называется теплообменом (теплопередачей).
Существует три вида теплообмена: теплопроводность, конвекция и излучение.
а) Теплопроводностью называется процесс теплообмена между телами (или частями тела) при их непосредственном контакте, обусловленный тепловым хаотическим движением частиц тела. Амплитуда колебаний молекул твердого тела тем больше, чем выше его температура. Теплопроводность газов обусловлена обменом энергией между молекулами газа при их столкновениях. В случае жидкостей работают оба механизма. Теплопроводность вещества максимальна в твердом и минимальна в газообразном состоянии.
б) Конвекция представляет собой теплопередачу нагретыми потоками жидкости или газа от одних участков занимаемого ими объема в другие.
в) Теплообмен при излучении осуществляется на расстоянии посредством электромагнитных волн.
Рассмотрим более подробно способы изменения внутренней энергии.
Механическая работа
При рассмотрении термодинамических процессов механическое перемещение макротел в целом не рассматривается. Понятие работы здесь связывается с изменением объема тела, т.е. перемещением частей макротела друг относительно друга. Процесс этот приводит к изменению расстояния между частицами, а также часто к изменению скоростей их движения, следовательно, к изменению внутренней энергии тела.
Изобарный процесс
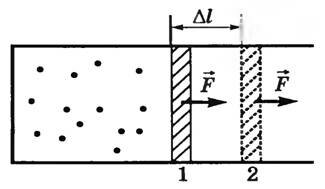
Рассмотрим вначале изобарный процесс. Пусть в цилиндре с подвижным поршнем находится газ при температуре T1 (рис. 1).
Будем медленно нагревать газ до температуры T2. Газ будет изобарически расширяться, и поршень переместится из положения 1 в положение 2 на расстояние Δl. Сила давления газа при этом совершит работу над внешними телами. Так как p = const, то и сила давления F = p⋅S тоже постоянная. Поэтому работу этой силы можно рассчитать по формуле
где ΔV — изменение объема газа.
- Если объем газа не изменяется (изохорный процесс), то работа газа равна нулю.
- Газ выполняет работу только в процессе изменения своего объема.
При расширении (ΔV > 0) газа совершается положительная работа (А > 0); при сжатии (ΔV < 0) газа совершается отрицательная работа (А < 0).
- Если рассматривать работу внешних сил A ' (А ' = –А), то при расширении (ΔV > 0) газа А ' < 0); при сжатии (ΔV < 0) А ' > 0.
Запишем уравнение Клапейрона—Менделеева для двух состояний газа:
Следовательно, при изобарном процессе
Если ν = 1 моль, то при ΔΤ = 1 К получим, что R численно равна A.
Отсюда вытекает физический смысл универсальной газовой постоянной: она численно равна работе, совершаемой 1 моль идеального газа при его изобарном нагревании на 1 К.
Не изобарный процесс
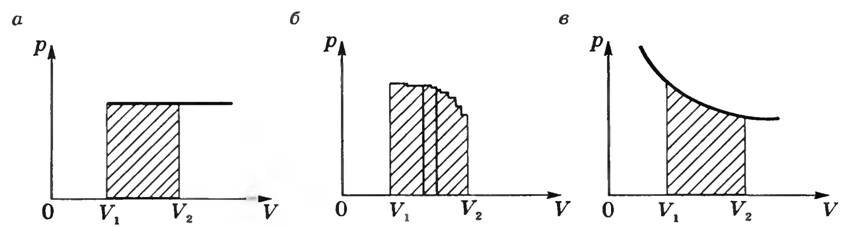
На графике p (V) при изобарном процессе работа равна площади заштрихованного на рисунке 2, а прямоугольника.
Если процесс не изобарный (рис. 2, б), то кривую функции p = f(V) можно представить как ломаную, состоящую из большого количества изохор и изобар. Работа на изохорных участках равна нулю, а суммарная работа на всех изобарных участках будет равна
т.е. будет равна площади заштрихованной фигуры.
При изотермическом процессе (Т = const) работа равна площади заштрихованной фигуры, изображенной на рисунке 2, в.
Определить работу, используя последнюю формулу, можно только в том случае, если известно, как изменяется давление газа при изменении его объема, т.е. известен вид функции p = f(V).
Таким образом, видно, что даже при одном и том же изменении объема газа работа будет зависеть от способа перехода (т.е. от процесса: изотермический, изобарный …) из начального состояния газа в конечное. Следовательно, можно сделать вывод, что
- Работа в термодинамике является функцией процесса и не является функцией состояния.
Количество теплоты
Как известно, при различных механических процессах происходит изменение механической энергии W. Мерой изменения механической энергии является работа сил, приложенных к системе:
При теплообмене происходит изменение внутренней энергии тела. Мерой изменения внутренней энергии при теплообмене является количество теплоты.
Количество теплоты — это мера изменения внутренней энергии в процессе теплообмена.
Таким образом, и работа, и количество теплоты характеризуют изменение энергии, но не тождественны внутренней энергии. Они не характеризуют само состояние системы (как это делает внутренняя энергия), а определяют процесс перехода энергии из одного вида в другой (от одного тела к другому) при изменении состояния и существенно зависят от характера процесса.
Основное различие между работой и количеством теплоты состоит в том, что
- работа характеризует процесс изменения внутренней энергии системы, сопровождающийся превращением энергии из одного вида в другой (из механической во внутреннюю);
- количество теплоты характеризует процесс передачи внутренней энергии от одних тел к другим (от более нагретых к менее нагретым), не сопровождающийся превращениями энергии.
Нагревание (охлаждение)
Опыт показывает, что количество теплоты, необходимое для нагревания тела массой m от температуры T1 до температуры T2, рассчитывается по формуле
где c — удельная теплоемкость вещества (табличная величина);
Единицей удельной теплоемкости в СИ является джоуль на килограмм-Кельвин (Дж/(кг·К)).
Удельная теплоемкость c численно равна количеству теплоты, которое необходимо сообщить телу массой 1 кг, чтобы нагреть его на 1 К.
Кроме удельной теплоемкости рассматривают и такую величину, как теплоемкость тела.
Теплоемкость тела C численно равна количеству теплоты, необходимому для изменения температуры тела на 1 К:
Единицей теплоемкости тела в СИ является джоуль на Кельвин (Дж/К).
Парообразование (конденсация)
Для превращения жидкости в пар при неизменной температуре необходимо затратить количество теплоты
где L — удельная теплота парообразования (табличная величина). При конденсации пара выделяется такое же количество теплоты.
Единицей удельной теплоты парообразования в СИ является джоуль на килограмм (Дж/кг).
Плавление (кристаллизация)
Для того чтобы расплавить кристаллическое тело массой m при температуре плавления, необходимо телу сообщить количество теплоты
где λ — удельная теплота плавления (табличная величина). При кристаллизации тела такое же количество теплоты выделяется.
Единицей удельной теплоты плавления в СИ является джоуль на килограмм (Дж/кг).
Сгорание топлива
Количество теплоты, которое выделяется при полном сгорании топлива массой m,
где q — удельная теплота сгорания (табличная величина).
Единицей удельной теплоты сгорания в СИ является джоуль на килограмм (Дж/кг).
Литература
Аксенович Л. А. Физика в средней школе: Теория. Задания. Тесты: Учеб. пособие для учреждений, обеспечивающих получение общ. сред, образования / Л. А. Аксенович, Н.Н.Ракина, К. С. Фарино; Под ред. К. С. Фарино. — Мн.: Адукацыя i выхаванне, 2004. — C. 129-133, 152-161.
Смотреть HD
видео онлайн
бесплатно 2022 года