SA. Пары
Материал из PhysBook
Испарение и конденсация
Содержание |
Парообразование — процесс перехода вещества из жидкого состояния в газообразное.
- Парообразование может происходить непосредственно из твердого состояния — это называется возгонка (или сублимация).
Совокупность молекул, вылетевших из вещества, называется паром этого вещества.
При парообразовании увеличиваются средние расстояния между молекулами. В результате потенциальная энергия взаимодействия частиц увеличивается (численное значение ее уменьшается, но она отрицательна). Таким образом, процесс парообразования связан с увеличением внутренней энергии вещества.
Парообразование может происходить непосредственно из твердого состояния — это возгонка (или сублимация).
Переход из жидкого состояния в газообразное возможен двумя различными процессами: испарением и кипением.
Испарение — это парообразование, происходящее со свободной поверхности жидкости при любой температуре.
Свойства испарения
Экспериментально установлены следующие cвойства испарения:
- При одинаковых условиях различные вещества испаряются с различной скоростью (скорость испарения определяется числом молекул, переходящих в пар с поверхности вещества за 1 с).
- Скорость испарения тем больше:
- чем больше площадь свободной поверхности жидкости;
- чем меньше плотность паров над поверхностью жидкости. Скорость увеличивается при движении окружающего воздуха (ветер);
- чем больше температура жидкости.
- При испарении температура тела понижается.
Механизм испарения можно объяснить с точки зрения MKT: молекулы, находящиеся на поверхности, удерживаются силами притяжения со стороны других молекул вещества. Молекула может вылететь за пределы жидкости лишь тогда, когда ее кинетическая энергия превышает значение той работы, которую необходимо совершить, чтобы преодолеть силы молекулярного притяжения (работа выхода). Поэтому покинуть вещество могут только быстрые молекулы. В результате средняя кинетическая энергия оставшихся молекул уменьшается, а температура жидкости понижается. Для того, чтобы поддерживать температуры испаряющейся жидкости неизменной, к ней необходимо подводить некоторое количество теплоты.
Молекулы пара хаотически движутся. Поэтому некоторые из них могут снова возвратиться в жидкость. Процесс перехода вещества из газообразного состояния в жидкое называется конденсацией.
Число возвратившихся в жидкость за определенный промежуток времени молекул тем больше, чем больше концентрация молекул пара, а следовательно, чем больше давление пара над жидкостью. Конденсация пара сопровождается нагреванием жидкости. При конденсации выделяется такое же количество теплоты, которое было затрачено при испарении.
Насыщенные и ненасыщенные пары
Над свободной поверхностью жидкости всегда имеются пары этой жидкости. Если сосуд с жидкостью не закрыт, то всегда найдутся молекулы пара, которые удаляются от поверхности жидкости и не могут вернуться назад в жидкость. В закрытом сосуде одновременно с испарением жидкости происходит конденсация пара. Сначала число молекул, вылетающих из жидкости за 1 с, больше числа молекул, возвращающихся обратно, и плотность, а значит, и давление пара растет. Число молекул пара возрастает до тех пор, пока число молекул, покинувших жидкость (испарившихся), не станет равно числу молекул, возвратившихся у жидкость (сконденсировавшихся) за один и тот же промежуток времени. Такое состояние называют динамическим равновесием.
Пар, находящийся в состоянии динамического равновесия со своей жидкостью, называется насыщенным паром. Для описания насыщенного пара применяют следующие величины: давление насыщенного пара pн и плотность насыщенного пара ρн. При данной температуры насыщенный пар обладает максимально возможным значением давления и плотности пара.
Пар, давление которого меньше давления насыщенного пара при данной температуре, называется ненассыщенным. Аналогично можно было дать определение и через плотность пара.
Опыт показывает, что ненасыщенные пары подчиняются всем газовым законам, и тем точнее, чем дальше они от насыщения.
Свойства насыщенных паров
Для насыщенных паров характерны следующие свойства:
- плотность и давление насыщенного пара зависят от рода вещества. Чем меньше удельная теплота парообразования жидкости, тем быстрее она испаряется и тем больше давление и плотность ее паров;
- давление и плотность насыщенного пара однозначно определяются его температурой (не зависят от того, каким образом пар достиг этой температуры: при нагревании или при охлаждении);
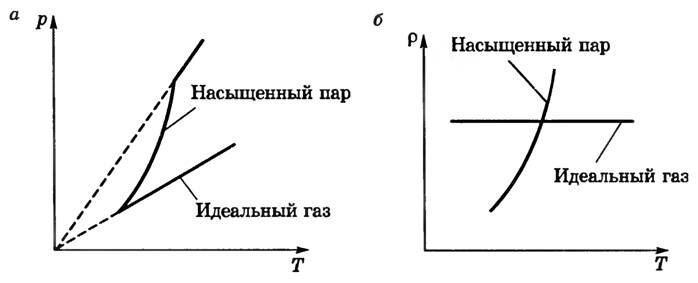
- в замкнутом сосуде (V = const) давление и плотность пара быстро возрастают с увеличением температуры (рис. 1, а, б). Более сильное увеличение давления насыщенного пара по сравнению с идеальным газом объясняется тем, что здесь происходит рост давления не только за счет роста средней кинетической энергии молекул (как у идеального газа), но и за счет увеличения концентрации молекул (было замечено, что при нагревании уровень жидкости в закрытом сосуде понижается, следовательно, масса и плотность пара возрастают). Таким образом, газовый закон для изохорного процесса не применим к насыщенному пару.
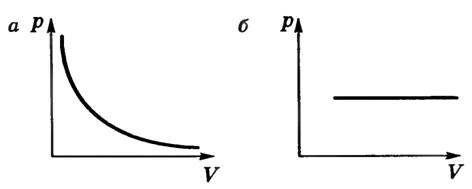
- при постоянной температуре давление и плотность насыщенного пара не зависят от объема. На рисунке 2 для сравнения приведены изотермы идеального газа (а) и насыщенного пара (б). Опыт показывает, что при изотермическом расширении уровень жидкости в сосуде понижается, при сжатии — повышается, т.е. изменяется число молекул пара так, что плотность пара остается постоянной. Таким образом, газовый закон для изотермического процесса также не применим к насыщенному пару;
- уравнение p = n⋅k⋅T описывает состояние насыщенного пара только приближенно.
Следовательно, насыщенный пар не подчиняется газовым законам идеального газа. Значения давления и плотности насыщенного пара при заданной температуре определяются из таблиц (см. таблицу).
| t, °С | р, кПа | ρ, г/м3 |
|---|---|---|
| 0 | 0,611 | 4,84 |
| 20 | 2,34 | 17,3 |
| 40 | 7,37 | 51,2 |
| 60 | 19,9 | 130 |
| 80 | 47,3 | 293 |
| 100 | 101,3 | 598 |
| 120 | 196 | 1122 |
Кипение жидкостей
Кипение — это парообразование, происходящее одновременно и с поверхности, и по всему объему жидкости. Оно состоит в том, что всплывают и лопаются многочисленные пузырьки, вызывая характерное бурление.
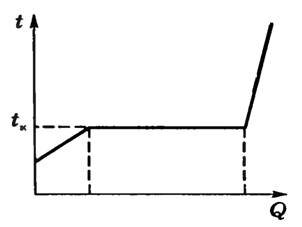
Как показывает опыт, кипение жидкости при заданном внешнем давлении начинается при вполне определенной и не изменяющейся в процессе кипения температуре и может происходить только при подводе энергии извне в результате теплообмена (рис. 3):

где L — удельная теплота парообразования при температуре кипения.
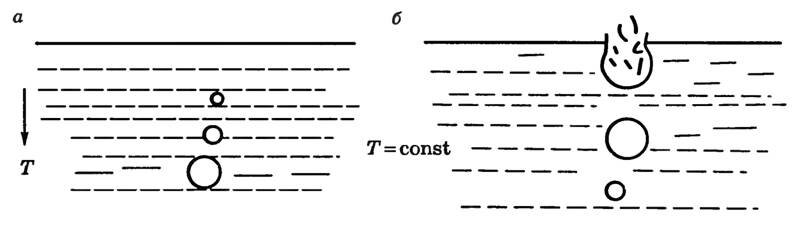
Механизм кипения: в жидкости всегда имеется растворенный газ, степень растворения которого понижается с ростом температуры. Кроме того, на стенках сосуда имеется адсорбированный газ. При нагревании жидкости снизу (рис. 4) газ начинает выделяться в виде пузырьков у стенок сосуда. В эти пузырьки происходит испарение жидкости. Поэтому в них, кроме воздуха, находится насыщенный пар, давление которого с ростом температуры быстро увеличивается, и пузырьки растут в объеме, а следовательно, увеличиваются действующие на них силы Архимеда. Когда выталкивающая сила станет больше силы тяжести пузырька, он начинает всплывать. Но пока жидкость не будет равномерно прогрета, по мере всплытия объем пузырька уменьшается (давление насыщенного пара уменьшается с понижением температуры) и, не достигнув свободной поверхности, пузырьки исчезают (захлопываются) (рис. 4, а), вот почему мы слышим характерный шум перед закипанием. Когда температура жидкости выравняется, объем пузырька при подъеме будет возрастать, так как давление насыщенного пара не изменяется, а внешнее давление на пузырек, представляющее собой сумму гидростатического давления жидкости, находящейся над пузырьком, и атмосферного, уменьшается. Пузырек достигает свободной поверхности жидкости, лопается, и насыщенный пар выходит наружу (рис. 4, б) — жидкость закипает. Давление насыщенного пара при этом в пузырьках практически равно внешнему давлению.
Температура, при которой давление насыщенного пара жидкости равно внешнему давлению на ее свободную поверхность, называется температурой кипения жидкости.
Так как давление насыщенного пара увеличивается с ростом температуры, а при кипении оно должно быть равно внешнему, то при увеличении внешнего давления температура кипения увеличивается.
Температура кипения зависит также от наличия примесей, обычно увеличиваясь с ростом концентрации примесей.
Если предварительно освободить жидкость от растворенного в ней газа, то ее можно перегреть, т.е. нагреть выше температуры кипения. Это неустойчивое состояние жидкости. Достаточно небольших сотрясений и жидкость закипает, а ее температура сразу понижается до температуры кипения.
См. также
- Кипение Wikipedia.org
- Уокер Дж. Как кипит вода?
Влажность воздуха
В результате испарения воды с многочисленных водоемов (морей, озер, рек и др.), а также с растительных покровов в атмосферном воздухе всегда содержится водяной пар. От количества водяного пара, содержащегося в воздухе, зависит погода, самочувствие человека, функционирование многих его органов, жизнь растений, а также сохранность технических объектов, архитектурных сооружений, произведений искусств. Поэтому очень важно следить за влажностью воздуха, уметь измерять ее.
Водяной пар в воздухе обычно является ненасыщенным. Перемещение воздушных масс, обусловленное в конечном счете излучением Солнца, приводит к тому, что в одних местах нашей планеты в данный момент испарение воды преобладает над конденсацией, а в других, наоборот, преобладает конденсация.
Воздух, содержащий водяные пары, называют влажным. Для характеристики содержания водяного пара в воздухе вводят ряд величин: абсолютную влажность и относительную влажность.
Абсолютной влажностью ρ воздуха называют величину, численно равную массе водяного пара, содержащегося в 1 м3 воздуха (т.е. плотность водяного пара в воздухе при данных условиях).
В СИ единицей абсолютной влажности является килограмм на кубический метр (кг/м3). Иногда используются внесистемные единицы грамм на кубический метр (г/м3).
Абсолютная влажность ρ и давление p водяного пара связаны между собой уравнением состояния

Если известна только абсолютная влажность, еще нельзя судить, насколько сух или влажен воздух. Для определения степени влажности воздуха необходимо знать, близок или далек водяной пар от насыщения.
Относительной влажностью воздуха φ называют выраженное в процентах отношение абсолютной влажности к плотности ρ0 насыщенного пара при данной температуре (или отношение давления p водяного пара к давлению p0 насыщенного пара при данной температуре):

Чем меньше относительная влажность, тем дальше пар от насыщения, тем интенсивнее происходит испарение. Давление насыщенного пара p0 при заданной температуре — величина табличная. Давление p водяного пара (а значит, и абсолютную влажность) определяют по точке росы.
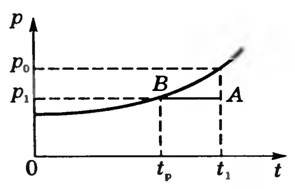
Пусть при температуре t1 давление водяного пара p1. Состояние пара на диаграмме р, t изобразится точкой А (рис. 5).
При изобарном охлаждении до температуры tp пар становится насыщенным и его состояние изобразится точкой В. Температуру tp, при которой водяной пар становится насыщенным, называют точкой росы. При охлаждении ниже точки росы начинается конденсация паров: появляется туман, выпадает роса, запотевают окна. Точка росы позволяет определить давление водяного пара p1, находящегося в воздухе при температуре t1.
Действительно, из рисунка 5 видим, что давление p1 равно давлению насыщенного пара при точке росы p1 = p0tp . Следовательно, 
Психрометр. Гигрометр
При понижении температуры, относительная влажность воздуха увеличивается. При некоторой температуре (точке росы) водяной пар становится насыщенным. Дальнейшее понижение температуры приводит к тому, что образующийся излишек водяных паров начинает конденсироваться в виде капелек росы или тумана.
Для определения относительной влажности воздуха, можно искусственно понизить температуру воздуха в какой-то ограниченной области до точки росы. Абсолютная влажность и, соответственно, давление водяных паров при этом останутся неизменными. Сравнивая давление водяного пара при точке росы с давлением насыщенного пара, которое могло бы быть при интересующей нас температуре, мы тем самым, найдем относительную влажность воздуха. Быстрого охлаждения можно добиться при интенсивном испарении какой-нибудь летучей жидкости. Такой метод применяют для измерении влажности при помощи конденсационного гигрометра.
Конденсационный гигрометр состоит из металлической коробочки с двумя отверстиями (рис. 6).
В коробочку заливается эфир. С помощью резиновой груши через коробочку прокачивается воздух. Эфир очень быстро испаряется, температура коробочки и воздуха, находящегося вблизи нее, понижается, а относительная влажность растет. При некоторой температуре, которая измеряется термометром, вставленным в отверстие прибора, поверхность коробочки покрывается мельчайшими капельками росы. Чтобы точнее зафиксировать момент появления на поверхности коробочки росы, эта поверхность полируется до зеркального блеска, а рядом с коробочкой для контроля располагается отполированное металлическое кольцо.
В современных конденсационных гигрометрах для охлаждения зеркальца пользуются полупроводниковым элементом, принцип действия которого основан на Пельтье эффекте, а температура зеркальца измеряется вмонтированным в него проволочным сопротивлением или полупроводниковым микротермометром.
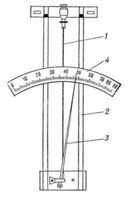
Действие волосного гигрометра основано на свойстве обезжиренного человеческого волоса изменять свою длину при изменении влажности воздуха, что позволяет измерять относительную влажность от 30 до 100%. Волос 1 (рис. 7) натянут на металлическую рамку 2. Изменение длины волоса передаётся стрелке 3, перемещающейся вдоль шкалы.
Действие керамического гигрометра основано на зависимости электрического сопротивления твердой и пористой керамической массы (смесь глины, кремния, каолина и некоторых окислов металла) от влажности воздуха.
Относительную влажность определяют также с помощью психрометра.
Психрометр состоит из двух термометров, шарик одного из них обмотан тканью, нижние концы которой опущены в сосуд с дистиллированной водой (рис. 8). Сухой термометр регистрирует температуру воздуха, а влажный — температуру испаряющейся воды. Но при испарении жидкости ее температура понижается. Чем суше воздух (меньше его относительная влажность), тем интенсивнее испаряется вода из влажной ткани и тем ниже ее температура. Следовательно, разность показаний сухого и влажного термометров (так называемая психрометрическая разность) зависит от относительной влажности воздуха. Зная эту разность температур, определяют относительную влажность воздуха по специальным психрометрическим таблицам.
- Гигрометр - от греч.Hygros - влажный.
- Психрометр - от греч.Psychros - холодный + Metreo - измеряю
См. также
- Гигрометр Wikipedia.org
- Измерители влажности воздуха и газов (гигрометр ВИТ, гигрометр электронный, гигрометр психометрический …)
- Относительная влажность Wikipedia.org
- Психрометр Wikipedia.org
Литература
- Аксенович Л. А. Физика в средней школе: Теория. Задания. Тесты: Учеб. пособие для учреждений, обеспечивающих получение общ. сред, образования / Л. А. Аксенович, Н.Н.Ракина, К. С. Фарино; Под ред. К. С. Фарино. — Мн.: Адукацыя i выхаванне, 2004. — C. 197-203.
- Жилко В.В. Физика: Учеб. пособие для 11-го кл. общеобразоват. шк. с рус. яз. обучения / В.В. Жилко, А.В.Лавриненко, Л.Г. Маркович. — Мн.: Нар. асвета, 2002. — С. 194-203.
- Открытая Физика
Смотреть HD
видео онлайн
бесплатно 2022 года