КС. Газовые законы
Содержание
Абсолютная температура
где T – абсолютная термодинамическая температура (по шкале Кельвина) (К); t – температура по шкале Цельсия (ºС).
- Более точно T = (t + 273,15) К. Использовать это значение будем в случае, если температуры заданы с точностью до десятых (тогда 273,2) или до сотых градуса.
Газовые законы
- Условия называются нормальными, если газ находится при температуре tну = 0 ºС и давлении pну = 101325 Па ≈ 105 Па.
Закон Бойля-Мариотта
Изотермический процесс (T = const, m = const):
где p1, p2 и p3 – давления газа в состоянии 1, 2 и 3 (Па); V1, V2 и V3 – объемы газа в состоянии 1, 2 и 3 (м3).
- При увеличении объема газа его давление во столько же раз уменьшается и наоборот. Этим можно воспользоваться для проверки результата.
Закон Шарля
- Изобарический закон в российских учебниках называется законом Гей-Люссака.
Процессы можно считать изобарными, если они проходят:
- в цилиндре с незакрепленным поршнем (без учета трения);
- в воздушных шариках при небольших растяжениях или сжатиях.
Изобарный процесс (p = const; m = const):
где V1 и V2 – объемы газа в состоянии 1 и 2 (м3); T1 и T2 – температуры газа в состоянии 1 и 2 (К).
- В уравнении задана абсолютная термодинамическая температура (по шкале Кельвина), причем T = (t + 273) К.
- Нет обязательного условия, чтобы начальный параметр был задан при 0 ºС.
- При увеличении объема газа его абсолютная температура во столько же раз увеличивается и наоборот. Этим можно воспользоваться для проверки результата.
Другой вариант записи
Изобарный процесс (p = const; m = const):
где ΔV = V - V0 – объемное расширение газа (м3); V0 – первоначальный объем газа при температуре t0 = 0 ºС (м3); V – конечный объем газа при температуре t (м3); αV – температурный коэффициент объемного расширения газа, постоянная величина, равная 1/273 ºС-1; Δt = t - t0 – изменение температуры тела (ºС); t – конечная температура тела (ºС); t0 – начальная температура тела (ºС).
- Начальный параметр обязательно должен быть задан при 0 ºС.
- Если объем газа увеличивается, то ΔV > 0, если уменьшается – ΔV < 0.
- Если температура увеличивается, то Δt > 0, если уменьшается – Δt < 0.
Закон Гей-Люссака
- Изохорный процесс в российских учебниках называется законом Шарля.
- Процессы можно считать изохорными, если они проходят в несжимаемом сосуде.
Изохорный процесс (V = const; m = const):
где p1 и p2 – давления газа в состоянии 1 и 2 (Па); T1 и T2 – температуры газа в состоянии 1 и 2 (К).
- В уравнении задана абсолютная термодинамическая температура (по шкале Кельвина), причем T = (t + 273) К.
- Нет обязательного условия, чтобы начальный параметр был задан при 0 ºС.
- При увеличении давления газа его абсолютная температура во столько же раз увеличивается и наоборот. Этим можно воспользоваться для проверки результата.
Другой вариант записи
Изохорный процесс (V = const; m = const):
где Δp = p - p0 – изменение давления газа (Па); p0 – первоначальное давление газа при температуре t0 = 0 ºС (Па); p – конечное давление газа при температуре t (Па); αp – температурный коэффициент давления газа, постоянная величина, равная 1/273 ºС-1 ; Δt = t - t0 – изменение температуры тела (ºС); t – конечная температура тела (ºС); t0 – начальная температура тела (ºС).
- Начальный параметр обязательно должен быть задан при 0 ºС.
- Если давление газа увеличивается, то Δp > 0, если уменьшается – Δp < 0.
- Если температура увеличивается, то Δt > 0, если уменьшается – Δt < 0.
Уравнение Клапейрона
При m = const:
где p1 и p2 – давления газа в состояниях 1 и 2 (Па); V1 и V2 – объемы газа в состояниях 1 и 2 (м3); T1 и T2 – абсолютная температуры газа в состояниях 1 и 2 (К).
Уравнение Клапейрона-Менделеева
где p – давление газа (Па); V – объем газа (м3); ν – количество вещества (моль); R – универсальная газовая постоянная, равная 8,31 Дж/(моль·К); T – абсолютная температура газа (К).
Закон Дальтона
где р – давление смеси газов (Па); p1, p2, …, pn – парциальные давления отдельных газов (Па).
Парциальное давление – это давление, которое имел бы каждый из газов, составляющих смесь, если удалить из сосуда остальные газы.
Построение графиков изопроцессов
При построении любого графика можно воспользоваться следующим планом:
- запишите уравнение функции, чей график мы будем строить;
- определите вид графика данной функции во всех осях;
- заполните таблицу значений давления, объема, температуры;
- постройте график (по точкам).
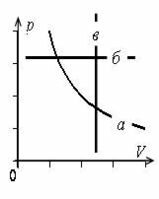
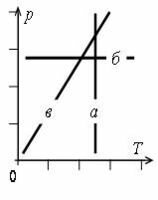
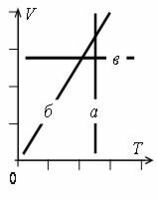
- Графики изопроцессов изображены на рис. 1, где а – график изотермического процесса; б – график изобарного процесса; в – график изохорного процесса.
- График постоянной величины – прямая, перпендикулярная оси с данной величиной.
- Все графики изопроцессов – прямые линии, перпендикулярные осям или проходящие через начало координат. Исключение составляет график изотермы в осях p(V).
- При построении графика масштаб выбираем таким, чтобы начальные и конечные значения величин укладывались на графике, и график при этом не был мелким.
Смотреть HD
видео онлайн
бесплатно 2022 года