Kvant. Электрохимия
А так ли хорошо знакома вам электрохимия? // Квант. — 2002. — № 5. — С. 32-33.
По специальной договоренности с редколлегией и редакцией журнала "Квант"
Так как внутреннее строение тел выведывает главным образом химия,
то без нее труден, даже невозможен доступ к их глубинам и
тем самым к раскрытию истинной причины электричества.
Михаил Ломоносов
...мои старые и новые открытия так называемого гальванизма...
проливают новый свет на теорию электричества;
открывают новые пути для химических исследований.
Алессандро Вольта
Химическая сила... прямо пропорциональна абсолютному количеству прошедшего электричества.
Майкл Фародей
Химия испытывает на себе влияние физики, пожалуй, сильней, чем любая другая наука.
Ричард Фейнман
Нет, мы вовсе не изменяем физической направленности нашего «Калейдоскопа». Напротив, стремимся показать, как далеко простирает и физика «руки свои в дела человеческие», в том числе и в химию. Еще важнее подчеркнуть, насколько плодотворен для развития наук бывает их союз, а порой и тесное переплетение, к скольким полезным свершениям он приводит. И одним из лучших примеров может послужить становление электрохимии - области, где иногда невозможно отделить физику от химии. Вспомните, например, на каких уроках вы изучаете в школе электролиз.
Впечатляет даже конспективное перечисление практических достижений электрохимии за ее более чем двухсотлетнюю историю.
Это создание постоянных батарей, аккумуляторов и различных разновидностей гальванических элементов, используемых теперь во всех отраслях техники и в быту. Если бы удалось одновременно включить все те миллиарды химических источников тока, что изготовлены сегодня на Земле, их мощность оказалась бы сравнимой с мощностью всех электростанций мира.
Это получение и очистка цветных металлов методом электролиза, внедрение гальванопластики и гальваностегии, решение проблемы опреснения воды и применение электродиализа для синтеза новых веществ, мониторинг окружающей среды с помощью химических сенсоров и имплантация электрокардиостимуляторов...
Но как бы ни были важны приложения электрохимии, нельзя забывать о той огромной теоретической роли,которую сыграли ее представления в развитии учения об электричестве и строении вещества. На это и хотим обратить ваше внимание при сегодняшнем кратком экскурсе в электрохимию.
Вопросы и задачи
- Присутствуют ли в электролитах свободные электроны?
- Всегда ли металл при погружении в электролит заряжается отрицательно?
- Почему вокруг электролита, например раствора поваренной соли, нет электрического поля, хотя внутри него имеются заряженные частицы - ионы?
- К электродам, погруженным в слабый раствор поваренной соли, подвели постоянное напряжение. Как будет меняться сила тока, проходящего через раствор, если в него постепенно подсыпать соль?
- Почему безводная серная кислота может храниться даже в железной посуде, а разведенная - только в стеклянной?
- Две одинаковые электролитические ванны соединены последовательно. В первой из них находится раствор CuCl, во второй - CuCl2. В какой из ванн на катоде выделяется больше меди?
- До каких пор будет продолжаться процесс электролиза медного купороса, если взяты угольные электроды; медные электроды?
- Полный ток в электролите складывается из тока положительных ионов и тока отрицательных ионов, движущихся в противоположных направлениях. Почему количество вещества, выделяющегося на катоде, рассчитывается по полному току, а не по току лишь положительных ионов?
- В каком случае опаснее браться за электрические провода - когда руки сухие или когда мокрые?
- Для чего в гальванотехнике применяют реверсирование, т.е. изменение направления тока?
- Через аккумулятор течет ток. Сравните разность потенциалов на клеммах аккумулятора с его ЭДС.
- При измерении ЭДС старой батарейки для карманного фонарика вольтметр показал значение, близкое к номинальному, но лампочка от этой батарейки не загорелась. Почему?
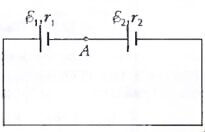
- Изобразите графически примерное распределение потенциала вдоль замкнутой цепи, изображенной на рисунке, если ε1 > ε2 и r1 < r2.
- Чтобы увеличить ток, протекавший в цепи одного аккумулятора, к нему присоединили второй. Однако как при последовательном, так и при параллельном соединении этих аккумуляторов получался меньший ток. В каком случае это возможно?
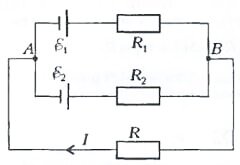
- В цепи, показанной на рисунке, увеличили сопротивление R1, из-за чего ток I также увеличился. Когда это возможно?
- Трамвайная линия питается постоянным током, причем воздушный провод присоединен к положительному полюсу генератора, а рельсы — к отрицательному. Почему так, а не наоборот?
- Почему гальванический элемент с небольшой — порядка нескольких вольт — ЭДС может дать значительный ток, а электростатическая машина, ЭДС которой достигает десятков тысяч вольт, дает ток ничтожной силы?
Микроопыт
Вы можете самостоятельно изготовить простейший гальванический элемент по известному старинному рецепту. Разрежьте лимон острым ножом поперек, стараясь сохранить перепонки, разделяющие дольки. В каждую дольку воткните попеременно кусочки медной и цинковой проволочек, соедините их попарно по кругу и от двух крайних сделайте два вывода («полюса»). Как проверить работоспособность такого элемента?
Любопытно, что…
...вероятно, первыми гальваническими элементами были найденные при раскопках вблизи нынешнего Багдада керамические сосуды, закрытые асфальтовой пробкой с пропущенными через нее железным и медным стержнями. Удивительно, что эти «приборы» заработали и через пять тысяч лет, стоило лишь залить в сосуды морскую воду либо скисшее вино.
...непосредственными предшественниками таких родоначальников электрохимии, как Гальвани и Вольта, были англичанин Пристли, первым применивший электрическую искру для получения азотной кислоты, итальянец Беккариа, схожим путем выделявший металлы из их окислов, и голландцы Дейман и Труствик, также искрой разлагавшие воду. А знаменитый Кавендиш в течение 53 дней непрерывно ставил опыты по воспламенению электрической искрой смеси кислорода и водорода, доказывая скептикам, что при их соединении получается ... просто вода.
...изобретатель химического источника электрического тока Вольта, как ни странно, не заинтересовался его применением в химии. Первенство в открытии такого важного явления, как электролиз, принадлежало двум английским любителям естествознания - литератору Никольсону и врачу Карлейлю - после первых же их опытов с вольтовой батареей в 1800 году.
...чтобы ощутить «вкус электричества». Вольта поставил известный опыт: он прикладывал к середине языка золотую монету или серебряную ложку, а к кончику - оловянную пластинку и, соединяя их, чувствовал кисловатый привкус.
...великий изобретатель Дэви, открывший некоторые новые химические элементы и веселящий газ, первым нашедший техническое приложение электролизу, придумавший безопасную рудничную лампу и предложивший способ защиты металлов от коррозии, самой большой своей заслугой считал открытие миру... Майкла Фарадея.
...предшествуя современному определению ампера, базирующемуся на магнитном взаимодействии токов, долгое время международным стандартом единицы силы тока служил эталон, созданный на основе первого закона Фарадея для электролиза, выполняемого с большой точностью.
...чем выше диэлектрическая проницаемость растворителя, тем больше степень диссоциации растворяемых в нем веществ. Поэтому, например, соляная кислота при растворении в воде дает электролит с высокой электропроводностью, а ее раствор в этиловом эфире, у которого проницаемость почти в 20 раз меньше, чем у воды, проводит электрический ток очень плохо.
...исследования электролитов привели ученых к логическому выводу о дискретности электрического заряда. Так, ирландский физик Стоней, опираясь на законы Фарадея для электролиза, высказал идею о дискретности электричества, рассчитал величину заряда одновалентного иона и предложил для него термин «электрон».
...в конце XIX века аккумуляторные электромобили успешно соперничали с тогда еще несовершенными машинами с двигателями внутреннего сгорания. Но сегодня ситуация обратная — несмотря на огромные усилия, задача создания конкурентоспособного электромобиля еще не решена.
...в последние десятилетия традиционные химические источники тока стали активно вытесняться на рынке элементами с использованием лития, обладающими широким температурным диапазоном работоспособности и превосходной — порядка 10 лет и более — сохранностью заряда.
Что читать в «Кванте» об электрохимии
- «Занимательный электролиз» — 1997, № 2, с. 40;
- «Участок цепи с источником тока» — 1997, № 3, с. 35;
- «Эти блуждающие токи» — 1998, № 3, с. 45;
- «Горки, электрические токи и Кулон» — 1999, № 1, с. 31;
- «Как покупать и как эксплуатировать батарейки?» — 2000, № 2, с. 18;
- «Вольта, Эрстед, Фарадей» — 2000, № 5, с. 16;
- «Электрические цепи постоянного тока» — 2001, № 3, с. 53.
Ответы
- Нет, только ионы и нераспавшиеся молекулы.
- Нет. Например, медный электрод при погружении в раствор медного купороса заряжается положительно.
- В каждой единице объема электролита находится столько же положительных зарядов, сколько и отрицательных, так что в среднем электролит не заряжен.
- Сила тока сначала будет расти, затем останется постоянной.
- Безводная серная кислота не является проводником. В присутствии же проводящей разбавленной кислоты, из-за наличия в железе примесей, в растворе могут возникать местные токи, приводящие к коррозии сосуда.
- Так как при электролизе через обе ванны пройдет одинаковый заряд, в первой ванне, где находятся одновалентные ионы меди, потребуется вдвое большее количество ионов для его переноса, чем во второй ванне, где валентность ионов меди равна двум. Следовательно, на катоде первой ванны выделится вдвое больше меди.
- При угольных электродах электролиз будет идти, пока из раствора не уйдут все ионы меди; при медных — пока не растворится анод.
- На месте выделенных в единицу времени на катоде положительных ионов и удаленных от него стольких же отрицательных ионов образуется такое же количество ионов обоих знаков из распавшихся молекул электролита (вследствие нарушения динамического равновесия). Положительные ионы также выделяются на аноде, в результате чего суммарный заряд, перешедший на катод за единицу времени, будет равен полному току.
- Влага на руках всегда содержит соли, поэтому является электролитом с хорошей проводимостью и создает хороший контакт между проводами и телом. Вот почему за электрические провода опаснее браться мокрыми руками.
- У выступов на поверхности металла напряженность электрического поля больше, чем у гладкой поверхности. При изменении направления тока, когда металл оказывается анодом, выступы растворяются быстрее и поверхность металла выравнивается.
- Если аккумулятор разряжается, то разность потенциалов на его клеммах меньше ЭДС на величину падения напряжения на его внутреннем сопротивлении; если заряжается, то разность потенциалов на такую же величину больше ЭДС.
- Внутреннее сопротивление старой батарейки велико. Вольтметр потребляет очень маленький ток, поэтому падение напряжения внутри батарейки при его подключении невелико. Но при подключении лампочки оно становится сравнимым с ЭДС, ток через нагрузку падает, и лампочка не загорается.
- См. рис.
- Если внутреннее сопротивление второго аккумулятора велико, а ЭДС мала по сравнению с первым аккумулятором.
- Если ε1 значительно меньше ε2, то ток, протекающий через первый элемент, направлен от B к A. При увеличении сопротивления R1 ток на участке BR1A уменьшается, что приводит к росту тока I на участке BRA.
- При противоположном подключении на рельсах, из-за электролиза грунтовой влаги, выделялся бы кислород, что приводило бы к нежелательной коррозии.
- Внутреннее сопротивление элемента невелико, а у электростатической машины оно достигает сотен миллионов ом.
Микроопыт
Действуйте по «методу Вольты» — коснувшись выводов языком, вы ощутите характерное пощипывание, будто от чего-то кислого.
Материал подготовил А.Леонович