Т. Изопроцессы
Частные случаи уравнения состояния идеального газа
Процессы, при которых один из параметров p, V или Τ остается постоянным, называют изопроцессами. Законы, описывающие изопроцессы в идеальном газе, были открыты экспериментально задолго до создания MKT идеального газа.
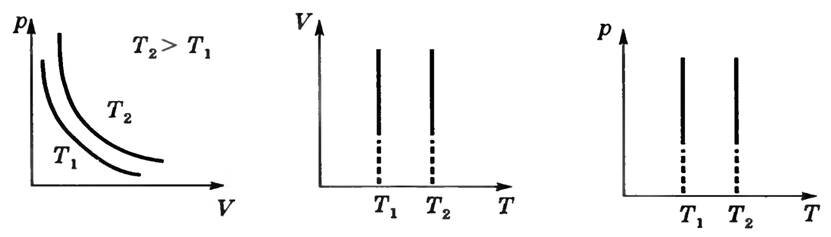
а) Изотермический процесс — процесс изменения состояния газа при постоянной температуре: Τ = const. Для его осуществления надо сосуд с поршнем, наполненный газом, привести в контакт с термостатом, т.е. телом настолько большой массы, что она обеспечивает постоянство температуры газа, даже когда отдает газу или получает от него некоторое количество теплоты.
В уравнении (3) при m = const и Μ = const \(~\frac mM RT = \operatorname{const}\). Тогда имеем
Формулы (1) описывают закон Бойля—Мариотта: при постоянной температуре, неизменной массе и неизменном химическом составе газа произведение давления на объем есть величина постоянная.
Графики зависимости между параметрами данной массы при постоянной температуре называются изотермами. На рисунке 1 изображены изотермы в осях (p, V), (V, Τ), (p, Т).
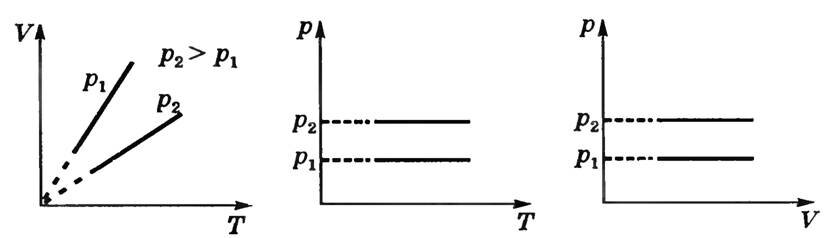
б) Изобарный процесс — процесс изменения состояния газа при постоянном давлении: p = const. Из уравнения (3) \(~\frac VT = \frac{mR}{Mp}\) отношение \(~\frac{mR}{Mp} = \operatorname{const}\) при m = const, Μ = const. Следовательно,
Уравнения (2) описывают закон Шарля: объем данной массы газа при постоянном давлении и постоянном химическом составе прямо пропорционален абсолютной температуре.
Закон Шарля можно записать через температуру t, измеряемую по шкале Цельсия\[~V = V_0 (1 + \alpha t)\], где V0 — объем газа при 0 °С, α = 1/273 К-1 — температурный коэффициент объемного расширения.
Графики зависимости между параметрами газа при постоянной массе газа и давлении называют изобарами (рис. 2).
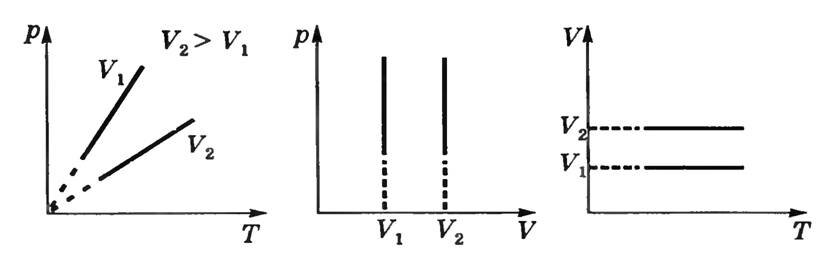
в) Изохорный процесс — процесс изменения состояния газа при постоянном объеме: V = const. Из уравнения (3) \(~\frac pT = \frac{mR}{MV}\). Для данной массы газа m = const и Μ = const отношение \(~\frac{mR}{V} = \operatorname{const}\) и
Уравнения (3) описывают закон Гей-Люссака: давление данной массы газа при постоянном объеме и постоянном химическом составе прямо пропорционально абсолютной температуре.
Если температуру измерять по шкале Цельсия, то закон Гей-Люссака запишется в виде\[~p = p_0 (1 + \alpha t)\], где p0 — давление газа при 0 °С, α — температурный коэффициент давления, оказавшийся одинаковым для всех газов: α = 1/273 К-1 .
Графики зависимости между параметрами газа при постоянной массе газа и постоянном объеме называют изохорами (рис. 3).
Тщательная экспериментальная проверка современными методами показала, что уравнение состояния идеального газа и вытекающие из него законы Бойля—Мариотта, Гей-Люссака и Шарля достаточно точно описывают поведение реальных газов при небольших давлениях и не слишком низких температурах.
Литература
Аксенович Л. А. Физика в средней школе: Теория. Задания. Тесты: Учеб. пособие для учреждений, обеспечивающих получение общ. сред, образования / Л. А. Аксенович, Н.Н.Ракина, К. С. Фарино; Под ред. К. С. Фарино. — Мн.: Адукацыя i выхаванне, 2004. — C. 144-146.