Т. Законы электролиза
Закон электролиза. Определение заряда электрона
Закон Фарадея для электролиза связывает массу выделяющегося вещества с прошедшим через электролит электрическим зарядом. При прохождении электрического тока через электролит происходит выделение на электродах составных частей электролита. Это явление называется электролизом (от греческого "лио" — разделяю). Электролиз связан с процессами обмена зарядами между ионами и электродами. На аноде отрицательно заряженные ионы (анионы) отдают свои лишние электроны (окислительная реакция), а на катоде положительные ионы (катионы) получают недостающие электроны (восстановительная реакция). Отдав свои избыточные заряды, ионы превращаются в нейтральные атомы. Эти атомы (или образованные из них молекулы выделяются на электродах, либо вступают в реакцию с электродами или растворителем. Химические реакции, в которые вступают нейтрализовавшиеся ионы, называются вторичными. Продукты вторичных реакций выделяются на электродах или переходят в раствор.
Рассмотрим несколько примеров, выражающих суть электролиза.
Пример 1
Пусть в электролитической ванне находится водный раствор соляной кислоты. Молекулы соляной кислоты при растворении в воде почти полностью диссоциируют на ионы водорода и ионы хлора:
При прохождении электрического тока через раствор на электродах происходит нейтрализация ионов.
Подойдя к аноду, Cl- отдает избыточный электрон, превращается в нейтральный атом Cl, атомы Cl сразу же объединяются попарно в молекулы Cl2:
и на аноде выделяется молекулярный хлор.
Атомы водорода, нейтрализовавшиеся у катода, объединяются попарно в молекулы H2:
и на катоде выделяется молекулярный водород.
Таким образом, в результате прохождения электрического тока через водный раствор HCl на катоде выделяется водород, на аноде — хлор. Вторичных реакций не происходит.
Пример 2
Молекулы серной кислоты при растворении в воде диссоциируют на ионы водорода и ионы кислотного остатка:
При прохождении электрического тока через раствор на электродах протекают следующие реакции:
Водород выделяется в виде пузырьков на катоде. Нейтральная группа SO4 химически очень активна и вступает во вторичную реакцию. Если электроды изготовлены, например, из платины или никеля, то SO4 реагирует с водой:
Молекула серной кислоты поступает в раствор, кислород выделяется в виде пузырьков у анода, т.е. вторичная реакция протекает с растворителем.
Пример 3
Пусть в электролитической ванне находится водный раствор сульфата меди. Под действием растворителя молекулы сульфата меди диссоциируют на ионы меди и ионы кислотного остатка:
При прохождении электрического тока через раствор на катоде ионы меди превращаются в нейтральные атомы \(~Cu^{2+} + 2e \to Cu\), и медь откладывается на катоде. На аноде происходит нейтрализация комплекса SO42-\[~SO_4^{2-} - 2e \to SO_4.\].
Если электроды медные, то нейтральная группа SO4 предпочтительнее вступает в реакцию с медью, чем с водой\[~SO_4 + Cu \to CuSO_4.\].
Молекула CuSO4 поступает в раствор. Вторичная реакция протекает с электродом из меди. Происходит отложение меди на катоде и растворение анода. Химический состав электролита при этом остается неизменным.
Необходимым условием электролиза является прохождение через электролит постоянного электрического тока.
Массу вещества, выделившегося при электролизе, можно рассчитать, пользуясь электронной теорией. Эта масса определяется массой всех N ионов, которые осели на электроде: m = m0N, где m0 — масса одного иона, N — число ионов, которое можно рассчитать, зная массу вещества m и его молярную массу М\[~N = \frac mM N_A\], где NA — число Авогадро.
С другой стороны, число ионов можно выразить через заряд q, про-шедший через электролит, и заряд одного иона qi\[~N = \frac{q}{q_i}\].
Следовательно, \(~\frac{q}{q_i} = \frac mM N_A \Rightarrow m = \frac{qM}{q_i N_A}\).
Заряд иона любого вещества кратен заряду одновалентного иона, т.е. заряду электрона qi = ne, где n — валентность иона.
Таким образом,
Величины Μ и n постоянны для данного вещества. Поэтому выражение \(~\frac{M}{ne N_A} = k\) — величина постоянная для данного вещества. Ее называют электрохимическим эквивалентом. Тогда m = kq.
Приведенная зависимость впервые была экспериментально установлена М. Фарадеем в 30-х годах XIX века. Эта формула выражает закон Фарадея: масса вещества, выделившегося на электроде, прямо пропорциональна заряду q. прошедшему через электролит:
Электрохимический эквивалент численно равен массе вещества, выделившегося на электроде при прохождении через раствор электролита заряда в 1 Кл. В СИ единицей электрохимического эквивалента является килограмм на кулон (кг/Кл) .
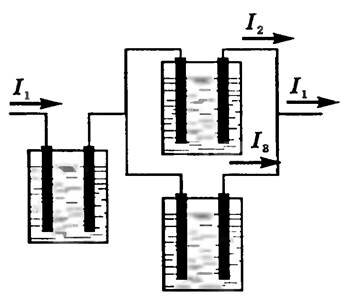
Убедиться в справедливости закона Фарадея можно на опыте. Соберем установку, показанную на рисунке 1. Все три электролитические ванны заполнены одним и тем же раствором электролита, но токи, проходящие через них, различны. Обозначим силы токов через I1, I2, I3. Тогда I1 = I2 + I3. Измеряя массы m1, m2, m3 выделившихся на электродах веществ в разных ваннах, можно убедиться, что они пропорциональны соответствующим силам тока I1, I2, I3.
Закон Фарадея сыграл важную роль в истории развития физики. Именно закон, полученный Фарадеем опытным путем, послужил толчком к выдвижению гипотезы о существовании в природе элементарного электрического заряда. Закон Фарадея позволяет определить заряд одновалентного иона (заряд электрона). Из формулы (1) \(~e = \frac{Mq}{m N_A n} = \frac{Mq}{m N_A} = \frac{MIt}{m N_A}\), т.е. надо измерить на опыте только массу выделившегося вещества m и силу тока в цепи I.
Литература
Аксенович Л. А. Физика в средней школе: Теория. Задания. Тесты: Учеб. пособие для учреждений, обеспечивающих получение общ. сред, образования / Л. А. Аксенович, Н.Н.Ракина, К. С. Фарино; Под ред. К. С. Фарино. — Мн.: Адукацыя i выхаванне, 2004. — C. 283-286.